La polémica destapada por una investigación periodística a nivel mundial sobre los fallos de los implantes médicos y la falta de controles «efectivos» para detectarlos no es ajena a la C. Valenciana. Según el trabajo del Consorcio Internacional de Periodistas de Investigación, que ha implicado a 59 medios internacionales (El Confidencial y La Sexta en España), en la última década se han registrado hasta 25.000 incidentes en España por fallos de control en implantes , también en hospitales valencianos.
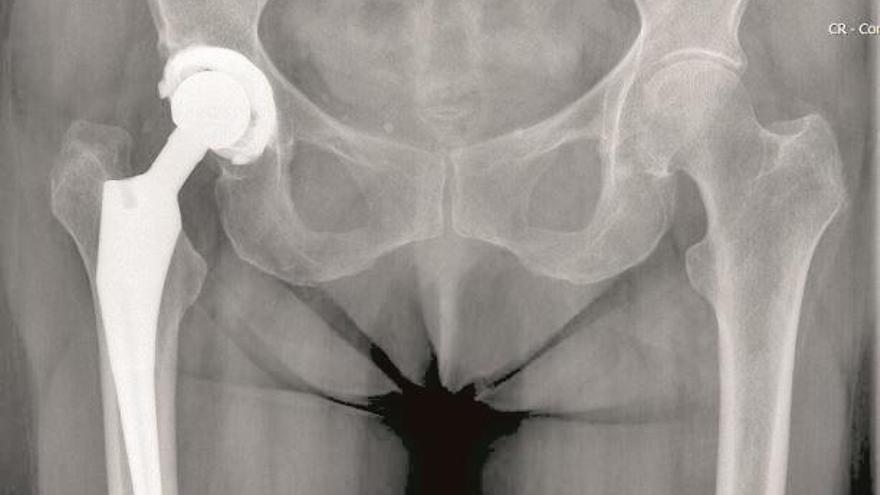
En el caso de las prótesis de cadera de la firma Depuy, los hospitales valencianos estaban entre los 70 centros donde se repartió y se implantó este dispositivo desde julio de 2003 hasta septiembre de 2010 cuando fue retirada en España tras la consiguiente alerta sanitaria. Cerca de 3.000 pacientes la recibieron en toda España.
«Tenía muchas ventajas pero nadie cayó en el problema que se podía generar por la liberación de iones». Lo dice el jefe de servicio de Traumatología de uno de los grandes hospitales valencianos que recuerda que en su servicio tuvieron que cambiar la prótesis a «casi todas las personas que habían recibido el implante», una decena solo en este hospital.
Según ha expuesto el trabajo de investigación, el dispositivo empezó a registrar «tasas de revisión» anormales, pese a eso, se seguían colocando. Aquellos que la recibieron sufrían a los años dolores e infecciones y debían pasar por el quirófano para reemplazar una cadera que, en teoría, debía durar hasta 20 años por un «aflojamiento» no esperado a los cinco años. A este problema se añadía la liberación de iones metálicos de cromo y cobalto, dañinos para la salud, al torrente sanguíneo.
Retirada en EE UU un año antes
«Cuando se dio la alerta teníamos pacientes operados y empezamos a hacer un seguimiento estrecho de los niveles de cromo y cobalto en sangre cada seis meses. Al final se terminó cambiando la prótesis a casi todos los pacientes, un 80 % diría yo», reconoce este traumatólogo. El problema es que la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), la responsable del control cuando se detectan estos fallos, lanzó la alerta de retirada en septiembre de 2010, cuando, y según se supo después, en EE UU y en Australia se suspendió su comercialización en 2009. Esta es una de las principales críticas que incluye el trabajo de investigación además de que los controles que se exigen a estos productos son más «laxos» que los que pasan los medicamentos.
Aún así, este profesional defiende el sistema de alertas de la Aemps. «Igual que en los medicamentos, tiene que haber unos ensayos clínicos previos y unas autorizaciones que pasar. No cualquier implante se puede poner, sí hay controles y funcionan aunque, como en todo, no puede haber garantías al 100 %».
La opinión de este traumatólogo coincide con la emitida ayer por la Federación de Asociaciones Científico Médicas Españolas, Facme, desde la que recordaron que en España, ni los profesionales médicos ni los centros sanitarios pueden adquirir o implantar dispositivos de «dudosa calidad, no autorizados, carentes de certificación europea o fuera del control sanitario». «Contamos con una excelente agencia gubernamental», añadieron. Aún así, abogaron por armonizar la regulación para los dispositivos médicos en Europa y de que, incluso, se genere alguna agencia europea para los productos sanitarios a semejanza de la Agencia Europea del Medicamento (EMA, por sus siglas en inglés). Si bien, ha insistido en la necesidad de que los ciudadanos tengan «plena confianza» en las instituciones sanitarias.