Científicos del EMBL Barcelona, laboratorio líder en Europa para las ciencias de la vida, han desarrollado un modelo 3D in vitro que imita cómo se forma la columna vertebral durante el desarrollo embrionario humano.
La columna vertebral es la estructura central de soporte del esqueleto. No sólo proporciona fijación para los músculos, sino que también protege la médula espinal y las raíces nerviosas. Se sabe que los defectos en su desarrollo causan enfermedades hereditarias raras.
La columna vertebral consta de 33 vértebras, que se forman a partir pares de estructuras precursoras llamadas somitas: no sólo dan lugar a las vértebras, sino también a las costillas y a los músculos del esqueleto.
Para garantizar la correcta formación de estas estructuras, el desarrollo de los somitas está estrechamente regulado y cada par de somitas surge en un momento determinado del desarrollo embrionario.
Este proceso está controlado por el reloj de segmentación, que es un grupo de genes que crea ondas oscilantes, cada una de las cuales da lugar a un nuevo par de somitas.
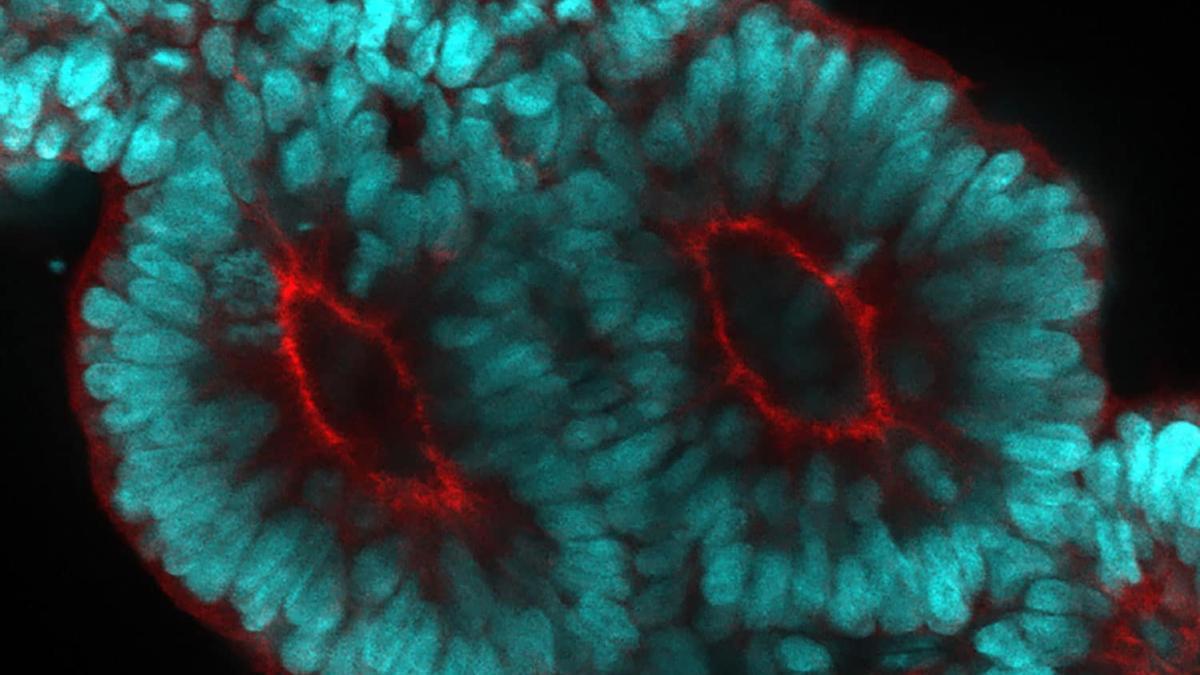
“Por primera vez, hemos podido crear en el laboratorio pares periódicos de somitas maduros humanos vinculadas al reloj de segmentación”, explica Marina Sanaki-Matsumiya, primera autora del estudio publicado en Nature Communications.
Proceso robusto
Para conseguirlo, el equipo cultivó células madre humanas pluripotentes inducidas (hiPSC por sus siglas en inglés) con un cóctel de moléculas de señalización que inducen la diferenciación celular.
Tres días después, los grupos de células comenzaron a alargarse y a crear ejes anteriores (arriba) y posteriores (abajo). En ese momento, los científicos añadieron Matrigel a la mezcla de cultivo.
Matrigel es lo que algunos científicos llaman el polvo mágico: una mezcla de proteínas que es crucial para varios procesos del desarrollo. Este proceso condujo finalmente a la formación de somitoides, que serían los equivalentes in vitro de las estructuras precursoras de los somitas humanos.
Para comprobar si el reloj de segmentación regula la somitogénesis en estos somitoides virtuales, los investigadores controlaron los patrones de expresión de HES7, el gen central implicado en el proceso.
Descubrieron claras evidencias de oscilaciones, especialmente cuando la somitogénesis estaba a punto de comenzar. Los somitas que se formaron también tenían claros marcadores de epitelización, un paso importante en su maduración.
El tamaño importa
El grupo de investigación que ha desarrollado esta iniciativa, liderado por la Dra. Miki Ebisuya, estudia cómo y por qué los humanos somos diferentes de otras especies en lo que respecta al desarrollo embrionario.
Uno de los sistemas modelo de diferencias entre especies que utilizan es el reloj de segmentación. En 2020, el grupo descubrió que el periodo de oscilación del reloj de segmentación humano es más largo que el del ratón. El estudio actual también muestra una relación entre el tamaño de los somitas y el reloj de segmentación.
“Los somitoides que creamos, independientemente del número de células iniciales, tenían un tamaño de somita que era constante. No aumentaba, aunque lo hiciera el número de células iniciales”, explica Sanaki-Matsumiya.
“Esto sugiere que los somitas tienen un tamaño preferido, que podría estar determinado por las interacciones locales célula-célula, el reloj de segmentación u otros mecanismos”, añade.
Más especies
Para profundizar en el estudio, Ebisuya y su grupo planean ahora cultivar somitoides de diferentes especies y compararlos. Los investigadores ya están trabajando con varias especies de mamíferos, como conejos, bovinos y rinocerontes, creando un “zoo de células madre” en el laboratorio.
“Nuestro próximo proyecto se centrará en crear somitoides de diferentes especies, medir su proliferación celular y la velocidad de migración de las células para establecer qué y cómo la somitogénesis es diferente entre las especies”, concluye Ebisuya.
Referencia
Periodic formation of epithelial somites from human pluripotent stem cells. Marina Sanaki-Matsumiya et al. Nature Communications, Volume 13, Article number: 2325 (2022). DOI:https://doi.org/10.1038/s41467-022-29967-1